Thu hồi toàn quốc lô thuốc Femancia của Medisun do không đạt tiêu chuẩn chất lượng
(VietQ.vn) - Cục Quản lý Dược (Bộ Y tế) vừa ra thông báo thu hồi trên toàn quốc lô thuốc viên nang cứng Femancia do Công ty cổ phần dược phẩm Medisun sản xuất. Lý do thu hồi là các lô thuốc này không đạt tiêu chuẩn về định lượng và độ hòa tan, có thể ảnh hưởng đến hiệu quả điều trị và an toàn của người sử dụng.
Lạm dụng thuốc giảm đau gây nguy hiểm nghiêm trọng cho sức khỏe
Coles, IGA thu hồi loạt sản phẩm salad nghi nhiễm khuẩn E. coli
Thu hồi dầu gội đầu Tec Italy Shampoo Totale do nguy cơ nhiễm khuẩn gây nhiễm trùng
Mới đây, Cục Quản lý Dược (Bộ Y tế) đã ban hành công văn thông báo về việc thu hồi trên toàn quốc lô thuốc viên nang cứng Femanicia do Công ty cổ phần dược phẩm Medisun (có trụ sở và nhà máy tại TP.Bến Cát, tỉnh Bình Dương) sản xuất.
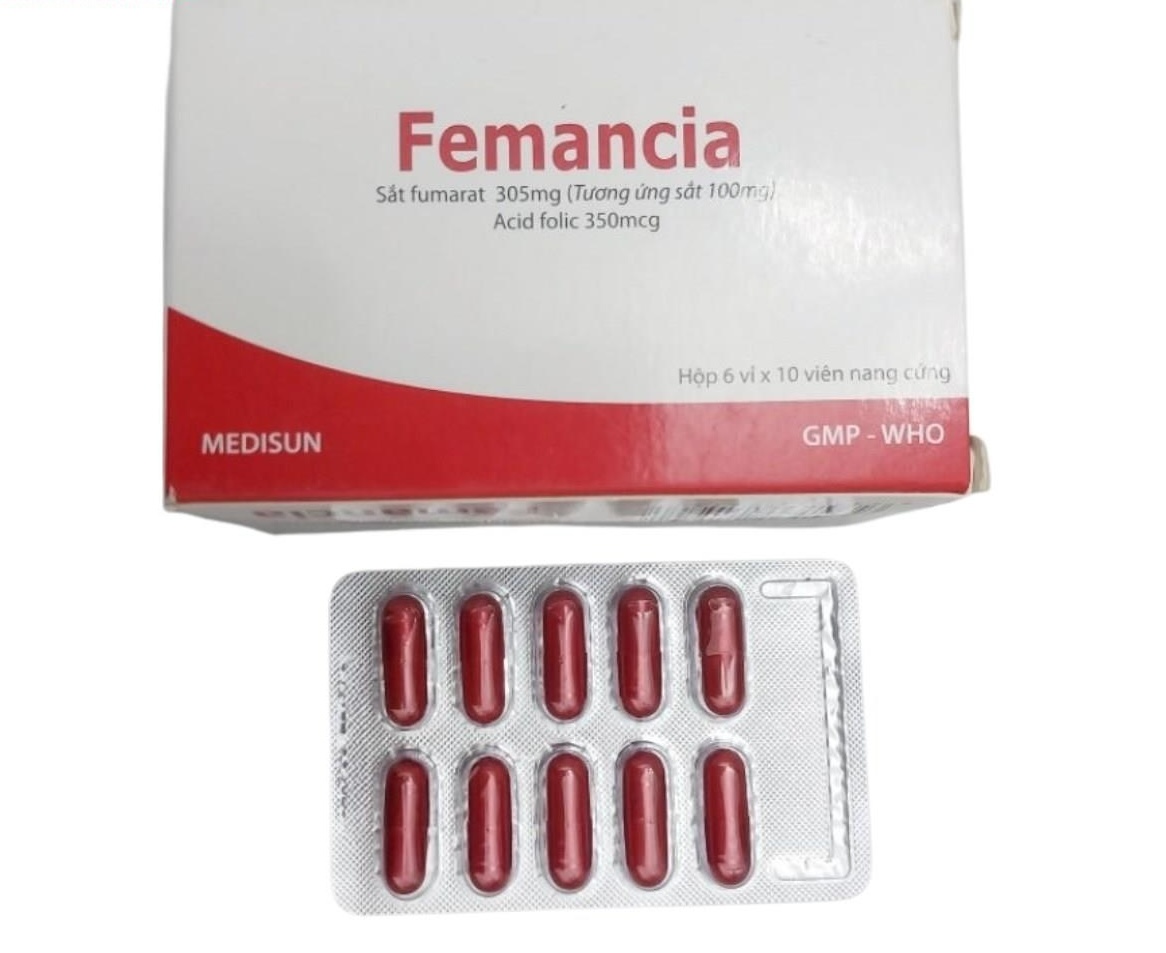
Viên nang cứng Femancia buộc phải thu hồi vì không đạt tiêu chuẩn về định lượng và độ hòa tan.
Theo kết quả kiểm nghiệm của Viện Kiểm nghiệm thuốc TP.HCM, lô thuốc Viên nang cứng Femancia (Sắt nguyên tố - Sắt fumarat 305 mg, Acid Folic 350 mg) có các số đăng ký và số lô cụ thể: Số GĐKLH: VD-27929-17, Số lô: 031222, NSX: 2/11/2022, HD: 2/12/2025, Số lô: 020223, NSX: 21/2/2023, HD: 21/2/2026. Qua kiểm tra, các lô thuốc này không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng và độ hòa tan, thuộc mức độ 2 theo quy định về vi phạm chất lượng thuốc.
Việc lô thuốc Femancia không đạt tiêu chuẩn có thể ảnh hưởng đến hiệu quả điều trị và an toàn của người sử dụng, đặc biệt là nhóm đối tượng cần bổ sung sắt như phụ nữ mang thai và người thiếu máu do thiếu sắt.
Với vi phạm nói trên, Cục Quản lý Dược yêu cầu Công ty cổ phần dược phẩm Medisun phối hợp cơ quan kiểm tra chất lượng, cơ quan kiểm nghiệm thuốc nhà nước tiến hành lấy 3 mẫu bổ sung đối với mỗi lô và gửi mẫu đã lấy tới Viện kiểm nghiệm thuốc Trung ương hoặc Viện khiểm nghiệm thuốc TP.HCM để kiểm tra chất lượng đối với chỉ tiêu định lượng, độ hòa tan.

Trụ sở Công ty cổ phần dược phẩm Medisun tại TP. Bến Cát, tỉnh Bình Dương.
Đồng thời, Công ty buộc thu hồi toàn bộ lô thuốc không đạt chất lượng trên toàn quốc. Trong vòng 2 ngày kể từ khi nhận được công văn, công ty phải gửi thông báo thu hồi đến tất cả cơ sở bán buôn, bán lẻ và sử dụng thuốc và gửi báo cáo thu hồi (bao gồm số lượng sản xuất, số lượng đã phân phối và số lượng thu hồi thực tế) về Cục Quản lý Dược trong vòng 18 ngày kể từ ngày ký.
Phối hợp các cơ quan kiểm nghiệm thuốc Nhà nước để lấy mẫu bổ sung và đánh giá lại chất lượng thuốc. Ngoài ra, Sở Y tế tỉnh Bình Dương, nơi công ty đặt trụ sở cũng được giao nhiệm vụ kiểm tra, giám sát quá trình thu hồi và xử lý thuốc vi phạm theo quy định.
Kim Thoa
















