Bộ Y tế rút công bố thuốc biệt dược của Công ty Sanofi-Aventis Việt Nam
(VietQ.vn) - Bộ Y tế vừa ban hành quyết định rút công bố thuốc biệt dược gốc ra khỏi Danh mục công bố thuốc biệt dược gốc của Bộ Y tế đối với Công ty TNHH Sanofi-Aventis Việt Nam do tiêu chuẩn chất lượng thuốc được công bố không thống nhất với tiêu chuẩn thuốc biệt dược gốc của nhà sáng chế.
Thuốc điều trị ung thư docetaxel gây cảm giác say rượu
Bộ trưởng Bộ Y tế: Không để bệnh nhi nằm gầm giường, hành lang
Bộ trưởng Bộ Y tế: 'Không có bệnh nhân, thầy thuốc chả để làm gì'
Thứ trưởng Bộ Y tế bà Nguyễn Thị Xuyên đã ký Quyết định 4243/QĐ-BYT, rút công bố thuốc biệt dược gốc ra khỏi Danh mục công bố thuốc biệt dược gốc của Bộ Y tế đối với Công ty TNHH Sanofi-Aventis Việt Nam. Công ty bị rút công bố do tiêu chuẩn chất lượng thuốc được công bố không thống nhất với tiêu chuẩn thuốc biệt dược gốc của nhà sáng chế.
Quyết định này được ban hành sau khi có biên bản kiểm tra của Đoàn kiểm tra Quyết định số 375/QĐ-QLD ngày 8/7/2015 của Cục trưởng Cục Quản lý Dược về việc thực hiện các quy định của pháp luật về đăng ký thuốc, kinh doanh thuốc sau khi được cấp số đăng ký lưu hành tại Công ty TNHH Sanofi Aventis Việt Nam ngày 26/8/2015.
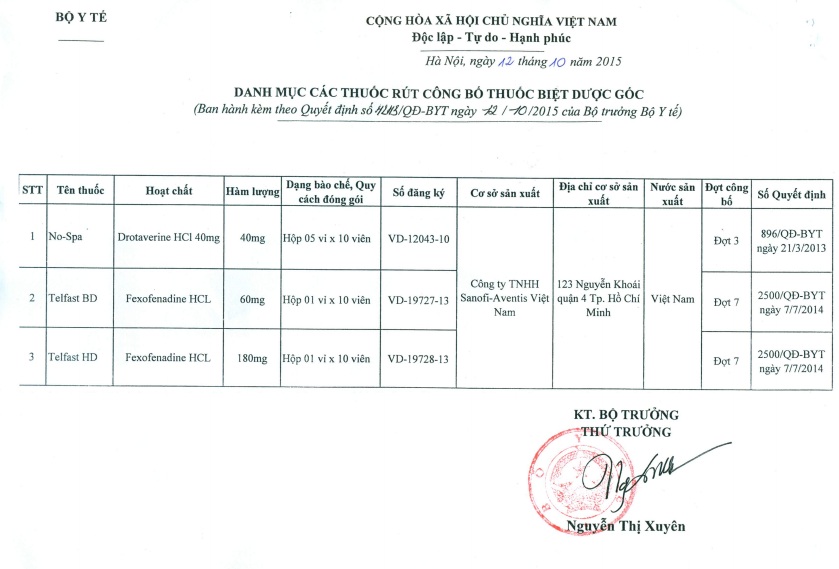
Bộ Y tế rút công bố thuốc biệt dược gốc ra khỏi Danh mục công bố thuốc biệt dược gốc đối với Công ty TNHH Sanofi-Aventis Việt Nam
3 loại thuốc biệt dược của Công ty TNHH Sanofi-Aventis Việt Nam bị rút công bố gồm: thuốc No-spa, số đăng ký VD- 12043- 10, hàm lượng 40mg; Telfast BD, số đăng ký: VD- 19727-13 hàm lượng 60mg; Telfast HD, số đăng ký: VD- 19728-13, hàm lượng 180mg
Vào trước đó, Cục Quản lý dược (Bộ Y tế) cũng ra quyết định rút số đăng ký (SĐK) 6 loại thuốc của Công ty TNHH Sanofi-Aventis Việt Nam với lý do, hồ sơ đăng ký thuốc có tiêu chuẩn chất lượng không đúng với tiêu chuẩn chất lượng thuốc biệt dược gốc của nhà sáng chế. Thuốc không đáp ứng yêu cầu công bố thuốc biệt dược gốc theo quy định của Bộ Y tế.
6 loại thuốc bị rút số đăng ký lưu hành tại Việt Nam, bao gồm: No-spa, SĐK: VD-12043-10; Telfast BD, SĐK: VD-19727-13; Telfast HD, SĐK: VD-19728-13; Amaryl (Glimepirid 1mg), SĐK: VD-22045-14; Amaryl (Glimepirid 2mg),SĐK: VD-22046-14; Amaryl (Glimepirid 4mg), SĐK: VD-22047-14, do côngty TNHH Sanofi-Aventis Việt Nam đăng ký, sản xuất.

Một trong các loại thuốc bị rút công bố do tiêu chuẩn chất lượng thuốc không thống nhất với tiêu chuẩn thuốc biệt dược gốc của nhà sáng chế
6 sản phẩm thuốc nói trên do tập đoàn Sanofi–Aventis (SA) sở hữu bản quyền, được sản xuất tại nhà máy SA Việt Nam, và đã nộp hồ sơ công bố thuốc biệt dược gốc. Tuy nhiên, quá trình hậu kiểm sau khi cấp số đăng ký, Cục Quản lý Dược đã phát hiện giới hạn của một số chỉ tiêu chất lượng thuốc sản xuất tại Việt Nam không thống nhất với tiêu chuẩn chất lượng sản phẩm được sản xuất tại nhà máy khác của tập đoàn SA đã được công bố thuốc biệt dược gốc và thấp hơn giới hạn quy định các Dược điển quốc tế được Bộ Y tế công nhận.
Vì vậy, để đảm bảo lợi ích của người sử dụng đối với các sản phẩm trên, đồng thời đảm bảo việc công bố thuốc biệt dược gốc phải tuân thủ đúng các tiêu chuẩn cao của sản phẩm phát minh nhằm sử dụng cho các yêu cầu điều trị đặc thù của các cơ sở y tế, Cục Quản lý Dược đã rút số đăng ký của các sản phẩm này, đồng thời chỉ đạo các Viện Kiểm nghiệm thuốc tiến hành lấy mẫu để kiểm tra chất lượng của các lô thuốc đã sản xuất theo tiêu chuẩn của thuốc biệt dược gốc.
Được biết, ngoài việc rút số đăng ký của các sản phẩm thuốc vi phạm, Cục Quản lý dược đã yêu cầu tạm dừng kinh doanh 6 thuốc nói trên. Quyết định này cũng đảm bảo việc công bố thuốc biệt dược gốc phải tuân thủ đúng các tiêu chuẩn cao đối với sản phẩm phát minh của các công ty đa quốc gia tại Việt Nam.
















