Những loại thuốc dạ dày đã bị thu hồi do kém chất lượng, chứa chất gây ung thư
(VietQ.vn) - Thời gian qua lực lượng chức năng đã thu hồi rất nhiều loại thuốc dạ dày do có thể gây ung thư, không đạt chất lượng theo quy định.
Thu hồi thuốc Rotunda của Dược phẩm Trung ương 2 không đạt tiêu chuẩn chất lượng
Tiếp tục thu hồi thuốc Levosum do không đạt tiêu chuẩn chất lượng
Thu hồi thuốc Npluvico do không đạt tiêu chuẩn chất lượng
Thu hồi thuốc Hepasyzin do không đạt chất lượng
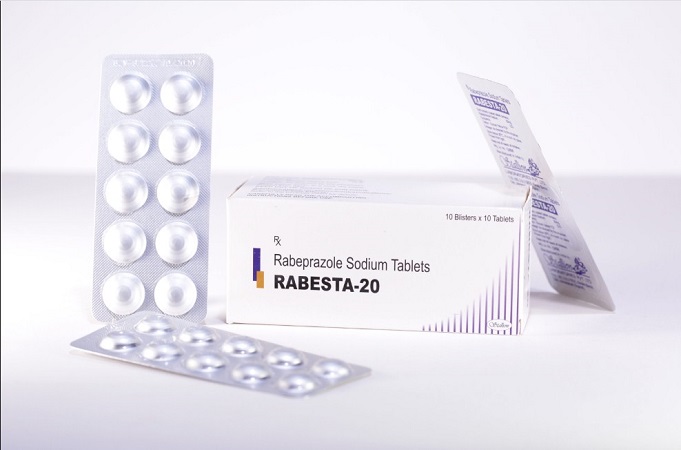
Thu hồi lô thuốc Rabesta 20 trào ngược dạ dày kém chất lượng
Mới đây, Cục Quản lý Dược (Bộ Y tế) đã ra thông báo thu hồi lô thuốc viên nén bao tan trong ruột Rabesta 20 (Rabeprazol natri 20 mg) vì không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan.
Theo đó, lô thuốc bị thu hồi là Rabesta 20 có số giấy đăng ký lưu hành VN-18521-14, số lô V-159, ngày sản xuất 14/2/2022, hạn dùng 13/2/2024. Sản phẩm do Stallion Laboratories Pvt. Ltd sản xuất, Công ty cổ phần dược - thiết bị y tế Đà Nẵng nhập khẩu.
Theo Cục Quản lý Dược, mẫu thuốc trên không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan trung bình dưới 50% so với tiêu chuẩn chất lượng, tức vi phạm mức độ 2.
Theo tìm hiểu, Rabesta 20 (Rabeprazol natri 20 mg) được chỉ định sử dụng cho người lớn để trị bệnh trào ngược dạ dày thực quản gây viêm loét.
Thuốc Pannefia-40 điều trị dạ dày bị thu hồi vì kém chất lượng
Sở Y tế Hà Nội đã có văn bản yêu cầu thu hồi thuốc điều trị dạ dày Pannefia-40 vì không đạt yêu cầu chất lượng. Theo đó thuốc Pannefia-40 là thuốc có tác dụng giảm tiết acid dịch vị, được sử dụng trong việc điều trị viêm loét dạ dày tá tràng, hội chứng trào ngược dạ dày thực quản.
Trước đó, Cục Quản lý Dược thông báo mẫu thuốc Pannefia-40 không đạt tiêu chuẩn chất lượng. Sở Y tế thông báo thu hồi thuốc Viên nén Pannefia-40 (Pantoprazol natri 40mg), số đăng ký: VN-15243-12, Lô SX: BNT0321058, ngày sản xuất 12/3/2021, hạn dùng 11/3/2024, do Công ty Brawn Laboratories Ltd (India) sản xuất, Công ty TNHH Dược phẩm Á Mỹ nhập khẩu.
Ba loại thuốc nhập khẩu chữa bệnh dạ dày, thực quản bị thu hồi giấy đăng ký lưu hành
Thuốc Pompezo 40mg, thuốc Pompezo 20mg và Ulsepan 40mg là 3 loại thuốc nhập khẩu vừa bị Bộ Y tế quyết định thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam.
Trong số này, thuốc Pompezo 40mg và 20mg là thuốc được chỉ định cho các trường hợp mắc trào ngược dạ dày-thực quản, viêm xước thực quản do trào ngược, điều trị dài hạn cho bệnh nhân viêm thực quản đã chữa lành để phòng ngừa tái phát…
Loại thuốc Ulsepan 40mg dạng viên nén bao tan trong ruột do Công ty TNHH MTV DP Altus là cơ sở đăng ký, chỉ định điều trị bệnh trào ngược dạ dày-thực quản, loét đường tiêu hóa…
Thu hồi 11 loại thuốc dạ dày có chất gây ung thư
Cục Quản lý Dược (Bộ Y tế) vừa ra văn bản thông báo thu hồi 11 loại thuốc chứa hoạt chất ranitidine do có tạp chất N-nitrosodimethylamine (NDMA, có nguy cơ gây ung thư) vượt giới hạn cho phép của quốc tế.
Trong số 11 loại thuốc có chứa hoạt chất ranitidine trên (trong đó có 9 loại là viên nén bao phim, 1 loại tiêm, 1 siro) đều là thuốc điều trị viêm loét dạ dày và ruột. Các thuốc này có xuất xứ từ Ấn Độ, Tây Ban Nha, Italy, Anh, Thái Lan, Malaysia. Cơ quan Khoa học y tế Singapore (HSA), Cơ quan Quản lý dược phẩm Thụy Sĩ (Swissmedic) cũng đã thu hồi 11 loại thuốc nói trên.
Trước đó, Cục Quản lý Dược cũng đã có văn bản gửi Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc TP.HCM, cơ sở sản xuất, nhập khẩu thuốc, nguyên liệu làm thuốc về việc phát hiện thuốc chứa ranitidine có chứa tạp chất NDMA vượt giới hạn cho phép.
Theo đó, Cục yêu cầu các cơ sở sản xuất thuốc chứa dược chất ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.
Cụ thể giới hạn NDMA tạm thời chấp nhận không quá 0.32 ppm (tính trên liều chấp nhận tối đa của NDMA là 96 nanogram/ngày và liều sử dụng tối đa của ranitidine là 300mg/ngày). Đồng thời, thực hiện đánh giá và kiểm soát chặt chẽ cơ sở cung ứng nguyên liệu, nguồn gốc nguyên liệu. Kiểm tra chất lượng từng lô nguyên liệu dược chất ranitidine theo quy định và phân tích bổ sung chỉ tiêu đối với tạp chất NDMA.
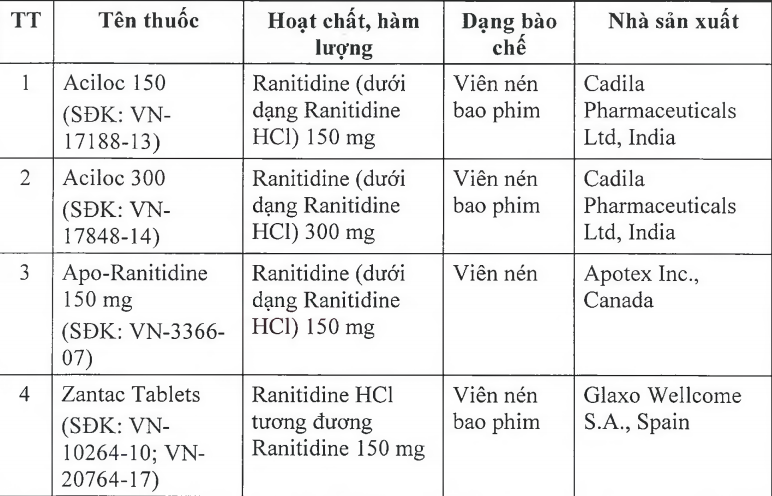
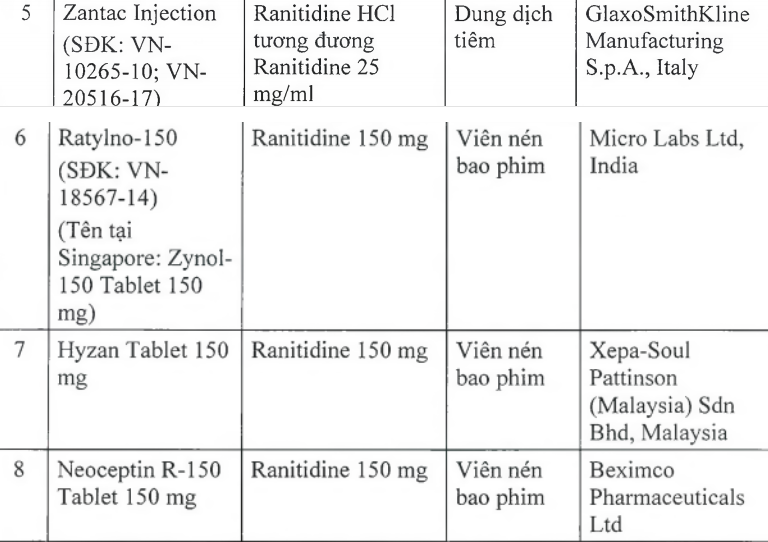
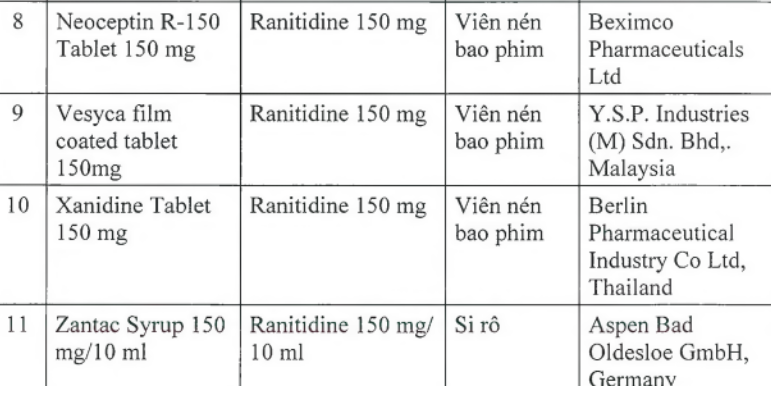
Theo đó, trong tháng 9, cơ quan Khoa học y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) lần lượt thu hồi 11 loại Zantac và thuốc generic có thành phần Ranitidine trên thị trường. Hong Kong và Ireland đã thu hồi lần lượt bốn và 13 sản phẩm.
Các chuỗi cửa hàng thuốc thuộc tập đoàn Walmart gồm CVS, Walgreen và Rite Aid ngừng bán các loại thuốc trị chứng ợ nóng dạ dày không kê đơn có chứa dược chất Ranitidine. Cơ quan y tế Canada yêu cầu ngừng phân phối các sản phẩm này trong lúc chờ đợi thu thập thêm thông tin.
An Dương (T/h)
















