Những loại thuốc điều trị dạ dày bị thu hồi do vi phạm về chất lượng
(VietQ.vn) - Thời gian gần đây lực lượng chức năng tiến hành thu hồi nhiều loại thuốc điều trị dạ dày do vi phạm về chất lượng cũng như nhập khẩu và lưu hành trái phép.
Nhật Bản thu hồi lô sữa đậu nành nghi nhiễm khuẩn Coliform của VinaSoy
Thu hồi thực phẩm bảo vệ sức khỏe Traly Vitamins không đạt tiêu chuẩn
Thu hồi thuốc Hepasyzin do không đạt chất lượng
Bộ Y tế cho biết, từ nguyên vật liệu sản xuất cho tới khi thành sản phẩm đến tay người sử sụng, thuốc phải trải qua nhiều giai đoạn. Các giai đoạn này đều có ảnh hưởng đến chất lượng thuốc nhưng vấn đề quan trọng nhất là việc sản xuất thuốc. Sản xuất thuốc tốt có ý nghĩa quyết định đến chất lượng thuốc, vì vậy cần tăng cường quản lý chất lượng thuốc để bảo đảm yêu cầu chăm sóc và bảo vệ sức khỏe nhân dân.
Trong thời gian qua lực lượng chức năng đã không ít lần buộc phải tiến hành thu hồi các loại thuốc không đạt chất lượng hay nhập khẩu và lưu hành trái phép. Một trong số những loại thuốc đó phải kể tới là thuốc điều trị dạ dày.
Buộc tiêu hủy lô thuốc trị trào ngược dạ dày Rabesta 20
Mới đây, Cục Quản lý Dược (Bộ Y tế) đã ra quyết định xử phạt vi phạm hành chính đối với Công ty Stallion Laboratories Pvt. Ltd với mức phạt là 120 triệu đồng, buộc tiêu hủy toàn bộ lô thuốc trị trào ngược dạ dày Rabesta 20 vi phạm chất lượng.
Đại diện chấp hành quyết định xử phạt vi phạm hành chính của công ty Stallion Laboratories Pvt. Ltd là Văn phòng đại diện tại TP HCM (ở phường Phú Mỹ, Quận 7). Công ty này đã sản xuất lô thuốc Rabesta 20 (Rabeprazol natri 20mg) vi phạm chất lượng mức độ 2. Thuốc này có số giấy đăng ký lưu hành VN-18521-14, lô vi phạm có số V-159, sản xuất ngày 14/2/2022, hạn dùng 13/2/2024 và thuốc có thay đổi lớn so với hồ sơ đăng ký (đã được phê duyệt) nhưng chưa được phê duyệt nội dung thay đổi theo quy định.
Ngoài số tiền xử phạt 120 triệu đồng, Cục Quản lý Dược cũng buộc tiêu hủy toàn bộ số thuốc Rabesta 20 (Rabeprazol natri 20mg) vi phạm chất lượng. Loại thuốc này được chỉ định sử dụng cho người trưởng thành bị trào ngược dạ dày thực quản gây viêm loét.
Bộ Y tế buộc tiêu hủy lô thuốc trị trào ngược dạ dày Rabesta 20 do vi phạm về chất lượng. Ảnh minh họa
Thu hồi thuốc Nexium 20mg nghi ngờ nhập khẩu/ lưu hành trái phép
Sở Y tế Ninh Bình đã có công văn về việc mẫu Voltarén Nexium 20mg, Nexium 40mg nghi ngờ là thuốc nhập khẩu/ lưu hành trái phép tại Việt Nam gửi UBND các huyện, thành phố; Các cơ sở y tế trên địa bàn tỉnh; Các cơ sở kinh doanh, sử dụng thuốc trong tỉnh.
Nội dung cụ thể như sau: Cục Quản lý Dược nhận được văn thư ngày 10/6/2022 của Công ty TNHH Astrazeneca Việt Nam về việc phát hiện các mẫu thuốc Nexium 20mg, Nexium 40mg nghi ngờ là thuốc nhập khẩu/ lưu hành trái phép tại Việt Nam.
Các thuốc Nexium 20mg (Enterik Kaph Pellet Tablet) và Nexium 40mg (Enterik Kaph Pellet Tablet) bao gồm cả thuốc Nexium có dán tem "Thuốc nhập khẩu song song, số GP: 2765/QLD-KD ngày 27/02/2013, DNNK: Công ty Cổ phần Armepharco" là thuốc không được phép nhập khẩu, lưu hành tại Việt Nam, mạo danh doanh nghiệp nhập khẩu.
Thuốc Nexium 20mg có thành phần chính là hoạt chất esomeprazole có tác dụng ức chế bơm proton, được chỉ định cho từng đối tượng trong các trường hợp mắc bệnh lý trào ngược dạ dày- thực quản và viêm loét dạ dày- tá tràng nguyên nhân sử dụng thuốc NSAID.
Thu hồi thuốc Pompezo 40mg và 20mg
Cục Quản lý Dược (Bộ Y tế) cũng đã ban hành quyết định thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với thuốc Pompezo 40mg và 20mg. Đây là thuốc được chỉ định cho các trường hợp mắc trào ngược dạ dày-thực quản, viêm xước thực quản do trào ngược, điều trị dài hạn cho bệnh nhân viêm thực quản đã chữa lành để phòng ngừa tái phát…Loại thuốc này do Công ty cổ phần Dược phẩm Minh Kỳ (địa chỉ tại TP.HCM) là cơ sở đăng ký thuốc. Cơ sở sản xuất thuốc là World Medicine Ilac San. ve Tic. A.S ở Thổ Nhĩ Kỳ.
Thu hồi 11 loại thuốc dạ dày có chất gây ung thư
Trước đó Cục Quản lý dược (Bộ Y tế) đã ra văn bản thông báo thu hồi 11 loại thuốc chứa hoạt chất ranitidine do có tạp chất N nitrosodimethylamine (NDMA, có nguy cơ gây ung thư) vượt giới hạn cho phép của quốc tế. Theo đó 11 loại thuốc có chứa hoạt chất ranitidine trên (trong đó có 9 loại là viên nén bao phim, 1 loại tiêm, 1 siro) đều là thuốc điều trị viêm loét dạ dày và ruột. Các thuốc này có xuất xứ từ Ấn Độ, Tây Ban Nha, Italy, Anh, Thái Lan, Malaysia. Cơ quan Khoa học y tế Singapore (HSA), Cơ quan Quản lý dược phẩm Thụy Sĩ (Swissmedic) cũng đã thu hồi 11 loại thuốc này.
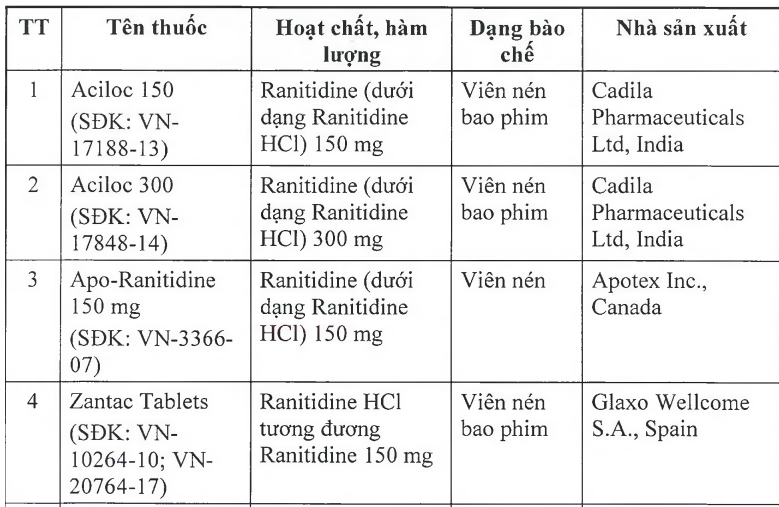
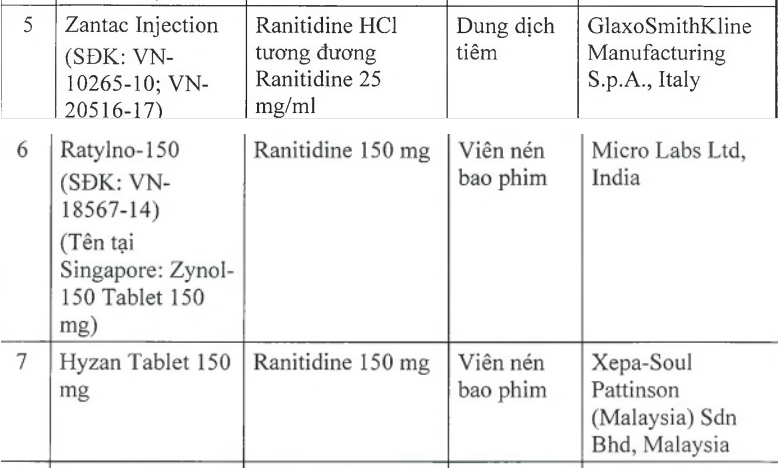
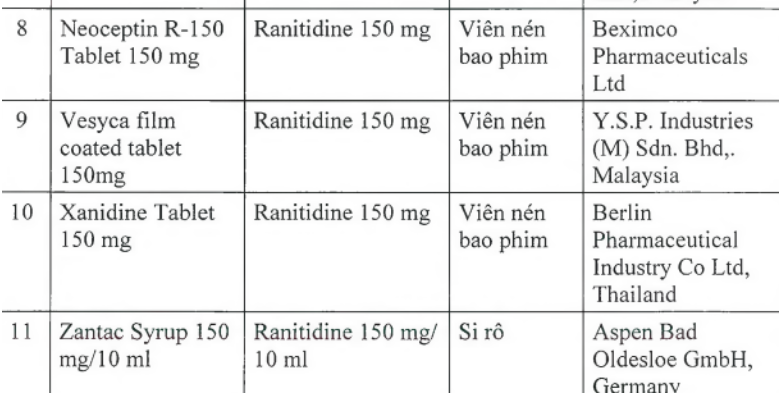
11 loại thuốc điều trị viêm loét dạ dày và ruột chứa chất gây ung thư bị thu hồi
|
Thông tư 11/2018/TT-BYT- Quy định về chất lượng thuốc, nguyên liệu làm thuốc Theo đó Thông tư trên áp dụng tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc như sau: Cơ sở kinh doanh dược, cơ sở pha chế thuốc áp dụng tiêu chuẩn chất lượng của thuốc, nguyên liệu làm thuốc theo dược điển hoặc theo tiêu chuẩn cơ sở đối với thuốc, nguyên liệu làm thuốc do cơ sở sản xuất, pha chế. Cơ sở kinh doanh dược, cơ sở pha chế thuốc phải tiến hành thẩm định, đánh giá phương pháp kiểm nghiệm ghi trong tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc do cơ sở sản xuất công bố áp dụng. Việc thẩm định phương pháp kiểm nghiệm thực hiện theo hướng dẫn về thẩm định quy trình phân tích của Hiệp hội các nước Đông Nam Á hoặc ICH được quy định tại Thông tư quy định việc đăng ký thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành. Bộ Y tế tổ chức thẩm định hồ sơ và phê duyệt tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc theo quy định về đăng ký thuốc, nguyên liệu làm thuốc, quy định về cấp phép nhập khẩu thuốc, nguyên liệu thuốc chưa có giấy đăng ký lưu hành. |
An Dương
















