Thu hồi giấy đăng ký lưu hành 3 thuốc giảm đau, điều trị rối loạn cương dương, béo phì
(VietQ.vn) - Ba loại thuốc trong danh sách thu hồi giấy đăng ký lưu hành tại Việt Nam có tác dụng giảm đau hạ sốt, điều trị rối loạn cương dương và điều trị béo phì.
Hoa Kỳ áp thuế chống bán phá giá tạm thời với vỏ viên nhộng cứng Việt Nam
Bộ Y tế thu hồi phiếu công bố hàng loạt sản phẩm mỹ phẩm
Thu hồi cá hồi nhồi hải sản bán tại chuỗi siêu thị Aldi do nguy cơ dị ứng đậu nành
Phó Cục trưởng Cục Quản lý Dược (Bộ Y tế) Nguyễn Thành Lâm vừa có quyết định thu hồi giấy đăng ký lưu hành tại Việt Nam với 3 thuốc: Tadalafil, Odistad và Vacobufen.
Lý do thu hồi là do cơ sở đăng ký đề nghị "tự nguyện thu hồi" giấy đăng ký lưu hành thuốc tại Việt Nam. Thuốc đã sản xuất trước ngày 3/6/2025 được phép lưu hành đến hết hạn dùng.
Thuốc Tadalafil 20mg (Tadalafil 20mg), có số đăng ký 893110457024 (SĐK cũ VD-31364-18), do Công ty liên doanh Meyer-BPC (địa chỉ tại phường Phú Tân, thành phố Bến Tre, tỉnh Bến Tre) đăng ký và sản xuất. Đây là một trong những loại thuốc phổ biến được sử dụng để điều trị rối loạn cương dương và các vấn đề về sinh lý ở nam giới.
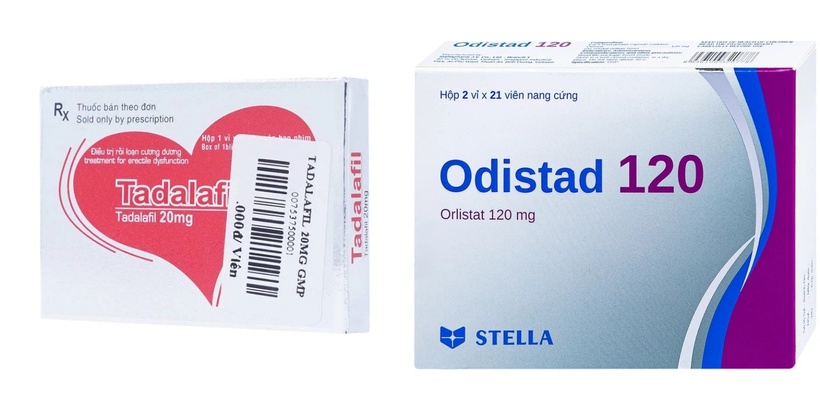 Bộ Y tế thu hồi đăng ký lưu hành ba loại thuốc
Bộ Y tế thu hồi đăng ký lưu hành ba loại thuốc Thuốc Odistad 120 (Orlistat 120mg), có số đăng ký 893100515124 (SĐK cũ: VD-21535-14) do Công ty TNHH liên doanh Stellapharm (địa chỉ tại huyện Hóc Môn, TPHCM) đăng ký; sản xuất tại Công ty TNHH liên doanh Stellapharm, Chi nhánh 1 (tại tỉnh Bình Dương). Thuốc có thành phần chính là Orlistat. Đây là một loại thuốc điều trị béo phì và phòng ngừa tăng cân trở lại ở người lớn.
Thuốc Vacobufen 400 (Ibuprofen 400mg), số đăng ký 893100032324 do Công ty cổ phần Dược Vacopharm (phường 1, thành phố Tân An, tỉnh Long An) đăng ký; sản xuất tại Công ty cổ phần Dược Vacopharm (phường Tân Khánh, thành phố Tân An, tỉnh Long An). Trên website doanh nghiệp này giới thiệu thuốc Vacobufen 400 có tác dụng giảm đau tạm thời các cơn đau, giảm sốt tạm thời.
Cục Quản lý Dược yêu cầu các cơ sở đăng ký thuốc, sản xuất thuốc phải có trách nhiệm theo dõi và chịu trách nhiệm về chất lượng, an toàn, hiệu quả của dược phẩm trong quá trình lưu hành.
Thời gian qua, nhà chức trách đã phát hiện một số vi phạm về sản xuất, phân phối, tuân thủ hồ sơ đăng ký và các quy định pháp luật trong lĩnh vực dược. Do đó, Bộ Y tế yêu cầu các sở y tế tăng cường kiểm tra, giám sát sản xuất dược phẩm và thực phẩm chức năng.
Đặc biệt, các cơ sở sản xuất thuốc phải thực hiện nghiêm quy chuẩn GMP (thực hành tốt sản xuất thuốc), kiểm soát nguồn gốc và chất lượng nguyên liệu. Mọi nguyên liệu dùng sản xuất đều phải đạt tiêu chuẩn và được Bộ Y tế phê duyệt trong hồ sơ đăng ký.
Bảo Linh
















