Quản lý hoạt động bán thuốc kê đơn gặp nhiều khó khăn
(VietQ.vn) - Theo Bộ Y tế, việc quản lý hoạt động bán thuốc kê đơn hiện gặp nhiều khó khăn do thói quen tự đến cơ sở bán lẻ thuốc để mua thuốc khi không đi khám, không có đơn thuốc, không thể giám sát hằng ngày...
FDA duyệt bộ xét nghiệm kháng nguyên COVID-19 tại nhà mà không cần kê đơn
Sản phẩm làng nghề - nâng tầm chất lượng thiết kế, đổi mới sáng tạo để phát triển bền vững
Nhận diện các dạng phòng chống lỗi sai Poka – Yoke để doanh nghiệp nâng cao năng suất
Luật Dược số 105/2016/QH13 được Quốc hội khóa XIII, kỳ họp thứ 11 thông qua ngày 06 tháng 4 năm 2016, có hiệu lực thi hành từ ngày 01 tháng 01 năm 2017. Qua 05 năm thực hiện, Luật cơ bản đã đáp ứng yêu cầu thực tiễn, tăng cường hiệu lực, hiệu quả của công tác quản lý nhà nước về dược, đảm bảo quyền của người dân được sử dụng thuốc có chất lượng, hợp lý và an toàn. Việc ban hành Luật Dược đã tạo điều kiện thuận lợi cho ngành Dược Việt Nam phát triển và hội nhập với các nước trong khu vực và trên thế giới. Trong báo cáo tổng kết thi hành Luật Dược 2016, Bộ Y tế cũng đã chỉ ra những kết quả đạt được và tồn tại, hạn chế trong hoạt động quản lý điều kiện kinh doanh dược.
Người dân tiếp cận thuốc dễ dàng hơn
Về kết quả đạt được, thực hiện các quy định của Luật Dược, Bộ Y tế và Sở Y tế là các cơ quan có thẩm quyền cấp giấy chứng nhận đủ điều kiện kinh doanh dược cho các cơ sở kinh doanh dược cũng như cấp phép nhập khẩu, xuất khẩu thuốc theo quy định. Việc triển khai các thủ tục trên đã được cải cách và dần chuyển sang thực hiện theo hình thức trực tuyến, rút ngắn thời gian xử lý, số lượng cơ sở được cấp phép đều tăng qua các năm góp phần tạo điều kiện thuận lợi cho doanh nghiệp và người dân được tiếp cận thuốc.
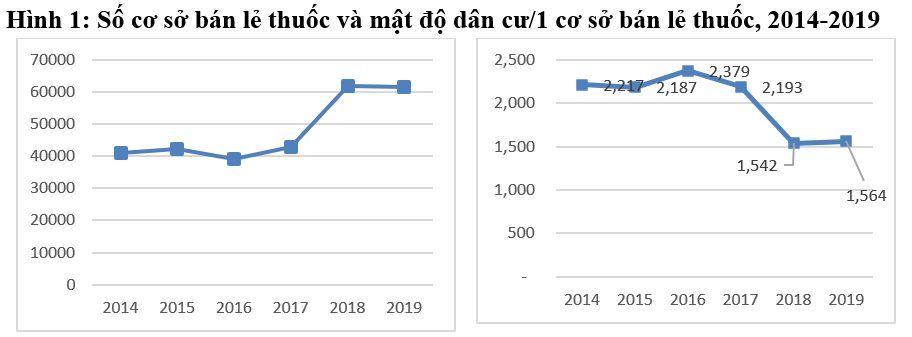
Số liệu Cục Quản lý Dược cho thấy số lượng đơn vị tham gia hoạt động kinh doanh thuốc cũng tăng lên trong giai đoạn 2015-2019 (Bảng 3). Tốc độ gia tăng trung bình về số lượng các đơn vị tham gia hoạt động kinh doanh trong giai đoạn 2015-2019 lần lượt là 6,4%, 25% và 11,6% đối với 3 lĩnh vực sản xuất dược phẩm, bán buôn và bán lẻ dược phẩm. Sự gia tăng này cho thấy khả năng cung ứng thuốc trên thị trường cũng được nâng lên.
Về hệ thống phân phối thuốc tại Việt Nam: khác với thị trường dược phẩm thế giới nơi nhà sản xuất và phân phối thường là các đơn vị độc lập nhằm tập trung hóa chuyên môn, hệ thống phân phối thuốc tại Việt Nam khác đặc thù với cấu trú phức tạp và sự tham gia của nhiều bên liên quan, bao gồm các thành phần tham gia chính như: doanh nghiệp phân phối thuốc chuyên nghiệp; các công ty dược vừa sản xuất vừa phân phối; hệ thống chợ thuốc; hệ thống bệnh viện công lập và bệnh viện tư nhân; hệ thống nhà thuốc, quầy thuốc; hệ thống phòng khám tư nhân.
Sau khi Luật Dược 2016 và các văn bản hướng dẫn ban hành và có hiệu lực, hoạt động phân phối, nhập khẩu thuốc tại Việt Nam có những thay đổi rõ nét như: phần lớn công ty, tập đoàn sản xuất dược phẩm nước ngoài có lượng hàng hóa phân phối tại thị trường Việt Nam từ 8 triệu USD trở lên bắt đầu thành lập các công ty tại Việt Nam và họ trở thành các cơ sở có quyền nhập khẩu nhưng không được thực hiện quyền phân phối thuốc. Các công ty dược của Việt Nam trở thành những nhà phân phối dược phẩm lớn, có nhiều hợp đồng với các nhà nhập khẩu không được quyền phân phối.
Có một hoạt động mới xuất hiện mạnh mẽ là cung cấp dịch vụ cho thuê kho bãi và các dịch vụ kèm theo cho các cơ sở có quyền nhập khẩu nhưng không được thực hiện quyền phân phối thuốc thành lập các kho nhập khẩu theo tiêu chuẩn thực hành tốt bảo quản thuốc – GSP.
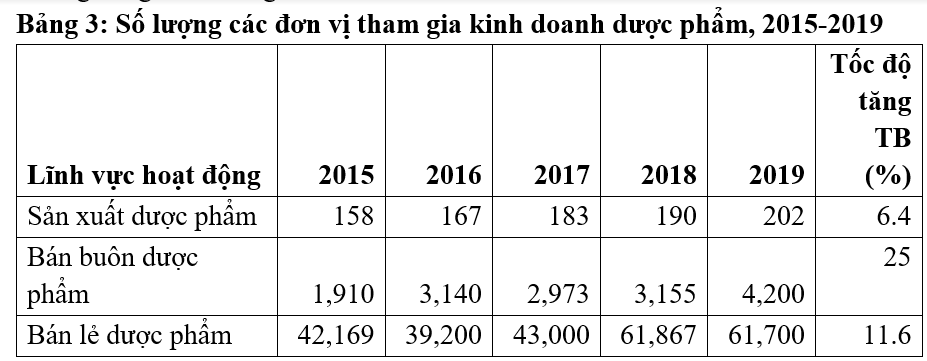
Trong đó, về việc cung ứng thuốc trong cộng đồng thông qua hệ thống cơ sở bán lẻ thuốc, tại Việt Nam số cơ sở bán lẻ thuốc tăng lên rõ rệt trong gian đoạn 2014-2019 (Hình 1). Sự gia tăng số cơ sở bán lẻ tạo điều kiện cho người dân tiếp cận thuốc thuận tiện hơn. Mật độ dân cư trên 1 cơ sở bán lẻ thuốc đã giảm từ 2.217 người xuống còn 1.564 người. So với số liệu quốc tế với mức trung vị 4.182 người trên 1 cơ sở bán lẻ thuốc cho thấy mức độ tiếp cận thuốc trong cộng đồng tại Việt Nam cao hơn nhiều mặt bằng chung quốc tế.
Để bảo đảm công tác phòng, chống dịch bệnh COVID-19, Bộ Y tế đã phê duyệt có điều kiện 09 loại vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh COVID-19 (COVID-19 Vaccine AstraZeneca; Comirnaty; Spikevax; COVID-19 Vaccine (Vero Cell), Inactivated; COVID-19 Vaccine Janssen; Abdala; Sputnik V; Hayat – Vax, Covaxin). Trên cơ sở đó, Bộ Y tế (Cục Quản lý Dược) đã cấp phép nhập khẩu khoảng hơn 342 triệu liều vắc xin cho nhu cầu cấp bách phòng, chống dịch theo quy định tại Điều 67 Nghị định số 54/2017/NĐ-CP (nhập khẩu để đáp ứng nhu cầu cấp bách trong phòng chống dịch bệnh. Theo quy định này, hồ sơ cần nộp rất đơn giản, nhiều tài liệu được miễn so với hồ sơ cấp giấy đăng ký lưu hành (CPP, giấy đăng ký lưu hành, hồ sơ chất lượng và an toàn, hiệu quả của vắc xin).
Qua 5 năm triển khai Luật Dược 2016, Cục Quản lý Dược là đơn vị đầu mối của Bộ Y tế trong việc cấp phép xuất khẩu, nhập khẩu thuốc, nguyên liệu làm thuốc cho các doanh nghiệp sản xuất, kinh doanh dược.
Điều 60 Luật dược năm 2016 đã quy định chi tiết về các trường hợp thuốc, nguyên liệu làm thuốc được xuất khẩu, nhập khẩu. Nghị định số 54/2017/NĐ-CP đã hướng dẫn chi tiết về hồ sơ, trình tự, thủ tục về việc xuất khẩu, nhập khẩu thuốc, nguyên liệu làm thuốc. Hiện nay, các thủ tục hành chính liên quan đến xuất khẩu, nhập khẩu thuốc, nguyên liệu làm thuốc đã được Cục Quản lý Dược triển khai trên hệ thống dịch vụ công trực tuyến và kết nối với Cổng Thông tin một cửa quốc gia góp phần làm giảm thủ tục hành chính và thuận tiện cho các cơ sở kinh doanh dược từ khâu cấp phép đơn hàng nhập khẩu thuốc, nguyên liệu làm thuốc đến làm thủ tục thông quan tại cơ quan hải quan.
Việc cấp phép xuất khẩu, nhập khẩu thuốc được thực hiện kịp thời góp phần đảm bảo nguồn cung ứng thuốc cho nhu cầu điều trị của người bệnh và các cơ sở y tế trên cả nước, đặc biệt đã kịp thời cấp phép nhập khẩu thuốc, vắc xin phòng chống dịch bệnh COVID-19 và các dịch bệnh truyền nhiễm trong thời gian qua.
Xuất hiện nhiều hạn chế, bất cập
Theo Bộ Y tế, số lượng cơ sở bán buôn thuốc, bán lẻ thuốc thuộc phạm vi Sở Y tế cấp Giấy chứng nhận đủ điều kiện kinh doanh dược phân bố không đồng đều, tập trung lớn tại một số địa phương như Hà Nội, thành phố Hồ Chí Minh, do vậy gây quá tải cho các Sở Y tế này trong tiến hành các thủ tục. Một số thủ tục thường xuyên phát sinh nhưng chưa được Bộ Y tế ban hành thủ tục hành chính như: “Thông báo đáp ứng thực hành tốt bảo quản thuốc” (GSP).
Việc đánh giá cơ sở thực hành tốt bán buôn thuốc (GDP) hiện nay không có bảng điểm kiểm tra (check list) như đánh giá cơ sở thực hành tốt bán lẻ thuốc (GPP), do đó gây khó khăn trong việc kết luận đánh giá GDP. Mạng lưới cung ứng thuốc và triển khai GPs còn nhiều tồn tại do tại các tỉnh miền núi, trình độ dân trí còn thấp, kinh tế còn nhiều khó khăn, các nhà thuốc và quầy thuốc chủ yếu kinh doanh nhỏ lẻ, doanh số bán thấp do vậy để thực hiện đầy đủ theo các tiêu chí Bộ Y tế đề ra gặp nhiều khó khăn; việc duy trì GPP chưa bền vững.
Đối với cơ sở kinh doanh đăng ký nhiều phạm vi: Cơ sở bán buôn thuốc, nguyên liệu làm thuốc; Cơ sở xuất khẩu, nhập khẩu thuốc, nguyên liệu làm thuốc;... do quy định về thẩm quyền cấp giấy chứng nhận đủ điều kiện kinh doanh dược dẫn đến các cơ sở phải tiếp nhiều đoàn đánh giá cho từng phạm vi.
Tại điểm p Khoản 2 Điều 42: Quyền và trách nhiệm của cơ sở kinh doanh dược quy định “Chỉ được bán thuốc kê đơn tại cơ sở bán lẻ thuốc khi có đơn". Tuy nhiên trong thực tế người bệnh có thói quen tự đến cơ sở bán lẻ thuốc để mua thuốc khi không đi khám và cũng không có đơn thuốc. Việc quản lý nhà nước về lĩnh vực này có hạn chế và khó khăn, vì không thể giám sát hàng ngày được và hiện tượng này còn xảy ra.
Thực tế trong quá trình triển khai, nhân sự phụ trách về bảo đảm chất lượng thuốc của các doanh nghiệp thường không ổn định, các doanh nghiệp liên tục thực hiện việc điều chỉnh Giấy chứng nhận đủ điều kiện kinh doanh dược do thay đổi người phụ trách bảo đảm chất lượng. Việc này gây khó khăn cho cơ quan quản lý do phải cần nhiều thời gian để xử lý các hồ sơ điều chỉnh Giấy chứng nhận và gây khó khăn cho doanh nghiệp cũng như người phụ trách đảm bảo chất lượng trong thời gian chờ cấp Giấy chứng nhận kinh doanh dược.
Hiện nay, thiếu quy định pháp lý và tài liệu hướng dẫn về kỹ thuật đối với cơ sở chuyên bán lẻ dược liệu, thuốc cổ truyền, thuốc dược liệu dẫn đến các Sở Y tế khó khăn trong công tác quản lý, thẩm định, cấp phép Giấy chứng nhận đủ điều kiện kinh doanh dược đối với các cơ sở này.
Hiện nay theo quy định tại Khoản 3 Điều 6 Luật Dược, Điều 82, Điều 84 Nghị định số 54/2017/NĐ-CP về nhập khẩu nguyên liệu làm thuốc chưa có giấy đăng ký lưu hành, các nguyên liệu này nhập về được sử dụng cho các mục đích cụ thể: làm mẫu kiểm nghiệm, nghiên cứu thuốc, sản xuất thuốc để xuất khẩu... thì chỉ được sử dụng đúng cho mục đích nhập khẩu ban đầu, không được chuyển đổi mục đích sử dụng.
Theo quy định tại khoản 4 Điều 60 Luật Dược, thuốc độc đã có giấy đăng ký lưu hành tại Việt Nam và nguyên liệu độc dùng để sản xuất thuốc đã có giấy đăng ký lưu hành tại Việt Nam nằm trong nhóm các thuốc phải được cấp giấy phép nhập khẩu, xuất khẩu và chỉ được phép nhập khẩu, xuất khẩu không quá số lượng cấp phép. Việc quản lý, cấp phép nhập khẩu thuốc độc như một thuốc phải kiểm soát đặc biệt là không cần thiết do hiện nay tất cả các thuốc nằm trong danh mục thuốc độc là những thuốc phải kê đơn, phần lớn sử dụng trong các cơ sở khám, chữa bệnh nên việc quản lý thuốc độc cần chú trọng chặt chẽ trong việc sử dụng thuốc (bán thuốc, kê đơn thuốc…) để đảm bảo an toàn cho người sử dụng.
Đối với thuốc, dược chất thuộc Danh mục chất bị cấm sử dụng trong một số ngành, lĩnh vực, việc quản lý lạm dụng các chất cấm sử dụng thuộc trách nhiệm của các bộ, ngành khác. Bộ Y tế chỉ có trách nhiệm quản lý sản phẩm sử dụng để phòng bệnh, chẩn đoán bệnh và điều trị bệnh. Hiện nay, tất cả chất cấm sử dụng trong các ngành khác mà được dùng làm dược chất sản xuất thuốc đều thuộc danh mục các thuốc phải kê đơn. Do đó, không cần thiết phải thực hiện các biện pháp kiểm soát đặc biệt đối với thuốc, dược chất thuộc Danh mục chất bị cấm sử dụng trong một số ngành, lĩnh vực và việc cấp giấy phép nhập khẩu, xuất khẩu các thuốc này cũng không cần thiết.
Theo quy định tại khoản 4 Điều 60 Luật Dược, vắc xin đã có giấy đăng ký lưu hành tại Việt Nam không nằm trong nhóm các thuốc phải được cấp giấy phép xuất khẩu, nhập khẩu và được phép xuất khẩu, nhập khẩu với số lượng không hạn chế tùy theo mục đích của doanh nghiệp. Tuy nhiên, việc quản lý vắc xin xuất khẩu, nhập khẩu cần đảm bảo chất lượng, an toàn trước khi đưa ra lưu hành trên thị trường. Theo yêu cầu của Tổ chức Y tế thế giới tại kỳ đánh giá cơ quan quản lý dược liên quan đến vắc xin (NRA) năm 2019, việc kiểm soát ở công tác cấp phép xuất khẩu, nhập khẩu là một trong những nội dung yêu cầu phải có trong toàn thể công tác quản lý vắc xin. Do đó, cần bổ sung thủ tục cấp giấy phép xuất khẩu, nhập khẩu đối với vắc xin.
Hán Hiển
















