Thu hồi khẩn thuốc xịt mũi ReBoost do nguy cơ nhiễm khuẩn
(VietQ.vn) - FDA vừa phát đi thông báo khẩn về việc thu hồi một lô thuốc xịt mũi ReBoost do nhiễm vi khuẩn và nhiều loại nấm gây hại cho sức khỏe con người.
Gần 17.000 bình nước trẻ em bị thu hồi do nguy cơ gây hóc
Tạm ngừng hồ sơ công bố và thu hồi lô mỹ phẩm Carebeau của Công ty Thương Tín
Thu hồi thuốc Diclofen trên toàn quốc do vi phạm mức độ 2 về chất lượng
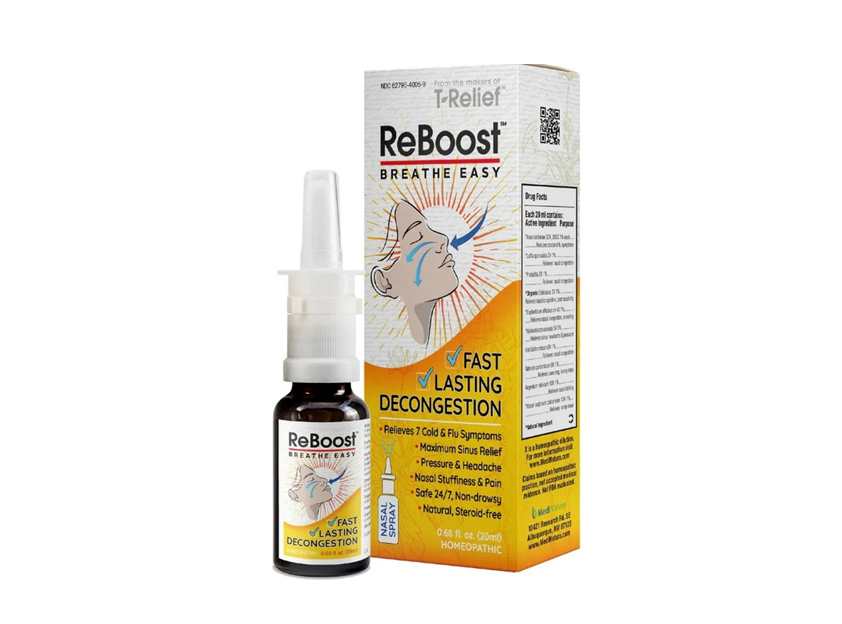
Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) vừa phát đi thông báo về việc thu hồi trên toàn nước Mỹ đối với một lô thuốc xịt mũi ReBoost Nasal Spray được sản xuất bởi công ty MediNatura New Mexico Inc., do phát hiện sản phẩm bị nhiễm vi sinh vật, trong đó có vi khuẩn ở mức độ không an toàn.
Theo FDA, quá trình kiểm tra cho thấy lô ReBoost Nasal Spray có chứa nấm men, nấm mốc và các vi sinh vật khác, bao gồm vi khuẩn Achromobacter. Đây là loại vi khuẩn có thể gây hậu quả nghiêm trọng về sức khỏe, đặc biệt nguy hiểm với những người có hệ miễn dịch suy yếu, thậm chí có thể dẫn tới các ca nhiễm trùng đe dọa tính mạng.
Tính đến thời điểm hiện tại, FDA cho biết chưa ghi nhận bất kỳ trường hợp bệnh lý nào liên quan trực tiếp tới việc sử dụng sản phẩm bị thu hồi. Các sản phẩm nằm trong diện thu hồi là các lọ thuốc xịt mũi ReBoost Nasal Spray có dung tích 0,68 fl oz (20 mL), có số lô 224268 và hạn sử dụng tới tháng 12/2027. Trên bao bì sản phẩm được ghi mã NDC: 62795-4005-9 và mã UPC: 787647 10186 3.
 Thu hồi khẩn thuốc xịt mũi ReBoost do nguy cơ nhiễm khuẩn.
Thu hồi khẩn thuốc xịt mũi ReBoost do nguy cơ nhiễm khuẩn.
Lô thuốc xịt mũi này được phân phối trên toàn nước Mỹ, thông qua các cửa hàng bán lẻ và kênh mua sắm trực tuyến trên website chính thức của MediNatura. FDA khuyến cáo người tiêu dùng nếu đang sở hữu sản phẩm thuộc lô thuốc bị thu hồi cần ngưng sử dụng ngay lập tức và mang sản phẩm trở lại nơi mua để được hoàn tiền.
Đồng thời, nếu nghi ngờ đã sử dụng sản phẩm bị nhiễm khuẩn và xuất hiện các triệu chứng bất thường về sức khỏe, người tiêu dùng cần liên hệ ngay với cơ sở y tế để được thăm khám kịp thời.
Được biết, mới đây, FDA cũng triển khai thu hồi hơn 11.000 lọ thuốc điều trị tăng huyết áp Ziac, được sản xuất bởi Glenmark Pharmaceuticals, thường được sử dụng trong điều trị bệnh tăng huyết áp.
Thông báo thu hồi được đưa ra sau khi kiểm tra mẫu cho thấy có dấu vết của một loại thuốc điều chỉnh mỡ máu do chính hãng này sản xuất.
Đến ngày 1/12, FDA phân loại đợt thu hồi ở mức độ nguy cơ Class III, tức nguy cơ gây hại thấp, khả năng ảnh hưởng đến sức khỏe người dùng là rất nhỏ, trong khi việc ngừng thuốc đột ngột có thể còn nguy hiểm hơn.
Đợt thu hồi ảnh hưởng đến thuốc kê đơn bisoprolol fumarate và hydrochlorothiazide hàm lượng 2,5 mg/6,25 mg, với các dạng đóng gói và mã số như sau:
Lọ 30 viên, mã NDC 68462 878 30, lô 17232401, hạn dùng 11/2025 Lọ 100 viên, mã NDC 68462 878 01, lô 17232401, hạn dùng 11/2025 Lọ 500 viên, mã NDC 68462 878 05, các lô 17232401 hạn dùng 11/2025 và 17240974 hạn dùng 05/2026 FDA không đưa ra hướng dẫn cụ thể cho người dùng, tuy nhiên với các đợt thu hồi thuộc Class III, khả năng xảy ra tác dụng phụ là rất thấp. Các chuyên gia cảnh báo người bệnh không nên tự ý dừng thuốc.
Bảo Linh (theo Pulmonologyadvisor)
















