Philips thu hồi hệ thống Tack Endovascular do nguy cơ gây biến chứng nghiêm trọng
(VietQ.vn) - Hãng Philips vừa thông báo thu hồi và ngừng phân phối hệ thống Tack Endovascular sau khi ghi nhận các sự cố trong quá trình sử dụng, khiến bệnh nhân phải thực hiện thêm các thủ thuật để định vị lại hoặc gỡ bỏ thiết bị cấy ghép.
Mỹ thu hồi sản phẩm hoa kim châm khô của Công ty US Trading do chứa sulfite chưa công bố
Thu hồi toàn quốc viên nang cứng Femancia do không đạt chất lượng
Thu hồi thuốc Pemetrexed SUN tại thị trường châu Âu do không đạt tiêu chuẩn
Thu hồi gần 120.000 vỉ thuốc Paracetamol do ghi nhầm dán nhãn
Thu hồi dưa chuột muối thương hiệu Baxter chứa chất gây dị ứng không được công bố
Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã xếp đây là loại thu hồi nghiêm trọng nhất, cảnh báo thiết bị có thể gây tổn thương nghiêm trọng hoặc tử vong nếu tiếp tục được sử dụng.
Theo đó, hệ thống Tack Endovascular được thiết kế chuyên dụng để điều trị tình trạng tách động mạch ngoại vi xảy ra sau phẫu thuật nong mạch, dù là trên đầu gối (ATK) hay dưới đầu gối (BTK).
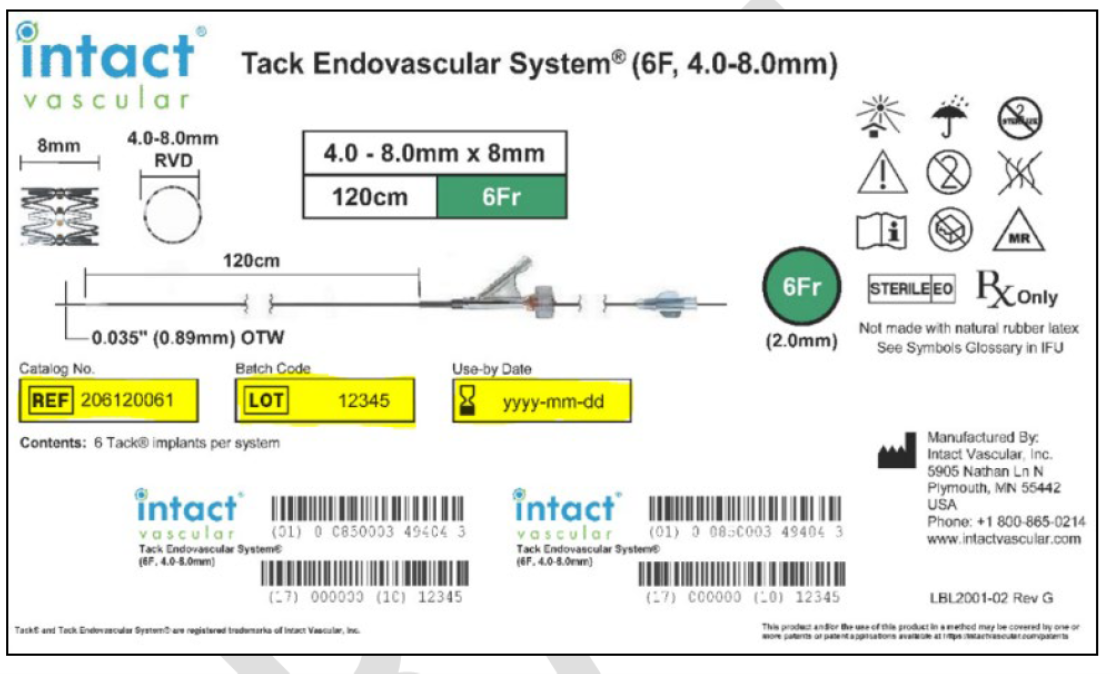 Sản phẩm bị ảnh hướng. (Ảnh: FDA)
Sản phẩm bị ảnh hướng. (Ảnh: FDA)
Các sản phẩm bị ảnh hưởng gồm Tack Endovascular System 4F (1.5-4.5mm, 150cm), Tack Endovascular System 6F (3.5-6.0mm, 135cm) và Tack Endovascular System 6F (4.0-8.0mm, 135cm), với các mã số lô sản xuất từ 331281 đến 349049. Philips đã gửi thư thu hồi khẩn cấp đến tất cả khách hàng từ ngày 10/01/2025, yêu cầu ngừng ngay việc sử dụng, kiểm tra và cách ly sản phẩm, không mở hoặc sử dụng thiết bị bị ảnh hưởng, đồng thời hoàn tất biểu mẫu phản hồi trong vòng bảy ngày để tiến hành quy trình thu hồi và hoàn tiền.
Lý do thu hồi xuất phát từ việc hệ thống Tack Endovascular có thể gây ra các biến chứng nguy hiểm như tắc mạch máu, thủng hoặc rách động mạch, đau đớn, hoại tử mô, tái hẹp mạch, cần phẫu thuật bắc cầu, thậm chí có thể dẫn đến cắt cụt chi hoặc tử vong. Hiện đã có 20 trường hợp bị tổn thương liên quan nhưng chưa ghi nhận ca tử vong nào.
Hệ thống Tack Endovascular vốn được sử dụng để điều trị bóc tách mạch máu sau khi nong mạch bằng bóng hoặc đặt stent. Thiết bị này giúp cố định mô bị tổn thương vào thành mạch để hỗ trợ quá trình phục hồi. Tuy nhiên, các sự cố trong thực tế đã khiến Philips quyết định ngừng phân phối sản phẩm này.
Các chuyên gia khuyến cáo bác sĩ và bệnh nhân cần theo dõi sát sao nếu đã sử dụng thiết bị này và báo cáo bất kỳ biến chứng nào đến cơ quan y tế. Người dùng tại Mỹ có thể liên hệ đại diện Philips để biết thêm chi tiết hoặc gửi phản hồi về các vấn đề liên quan đến hệ thống Tack Endovascular thông qua chương trình MedWatch của FDA.
Hiện chưa có thông báo chính thức nào từ Bộ Y tế hoặc Cục Quản lý Trang thiết bị Y tế Việt Nam về việc hệ thống Tack Endovascular của Philips được nhập khẩu hoặc sử dụng tại Việt Nam. Tuy nhiên, với xu hướng hội nhập và việc thiết bị y tế ngày càng được cập nhật từ các thị trường quốc tế, các cơ sở y tế tại Việt Nam – đặc biệt là bệnh viện chuyên khoa tim mạch và trung tâm can thiệp mạch máu – cần chủ động rà soát kho thiết bị của mình. Nếu phát hiện có sản phẩm thuộc danh mục bị thu hồi, các cơ sở nên ngừng sử dụng ngay lập tức, cách ly sản phẩm và liên hệ với đại diện của Philips hoặc nhà cung cấp để được hướng dẫn xử lý theo quy trình thu hồi khẩn cấp.
Duy Trinh (theo FDA)
















